Usualmente siamo abituati alla visione in 3D dei film al cinema, in cui le immagini prendono forma grazie a quegli occhialini con le lenti rosse e blu che ci danno in dotazione.
Ma se vi dicessimo che anche nella biologia esiste il 3D?
Nel cuore della biologia moderna, grazie ai passi da gigante fatti nello studio del funzionamento delle cellule e della loro interazione, queste prendono vita in strutture tridimensionali complesse finalizzate alla migliore comprensione delle cellule in condizioni fisiologiche e patologiche.
Esplorando il mondo del tridimensionale, vediamo come soprattutto quattro tipi di modelli 3D cellulari, sferoidi, organoidi, blastoidi e gastruloidi, svolgono un ruolo determinante nella ricerca.
Sferoidi Cellulari: Un’Introduzione al 3D
Possiamo dire che, come la palla sta allo sport, gli sferoidi stanno alla biologia cellulare 3D.
Questi sono stati uno dei primi tentativi di ricreare l’ambiente tridimensionale delle cellule in vitro. Gli sferoidi, proprio come suggerisce il nome, sono degli aggregati cellulari auto-assemblati formanti sfere che non hanno una struttura complessa come i tessuti, ma sono utilizzati per riprodurre in maniera più fedele l’architettura cellulare e il microambiente in cui le cellule si trovano in vivo.
Sono utilizzati per avere una maggiore comprensione dei processi biologici, come può essere una crescita tumorale o una risposta ad un determinato farmaco o contaminante. Inoltre, è stato dimostrato come effettivamente questi abbiano una sensibilità migliore ai farmaci rispetto alle colture cellule in 2D (monostrato), rappresentando una nuova chiave di lettura nella valutazione dell’efficacia dei trattamenti come possono essere quelli antitumorali.
Gli sferoidi possono essere formati da diverse tipologie cellulari: possono essere costituiti da cellule tumorali, cellule staminali o cellule di un particolare tessuto come quello epatico con gli epatociti.
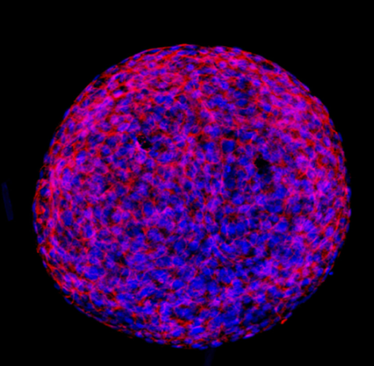
È anche bene, però, evidenziare che gli sferoidi possono avere delle limitazioni, tra cui la difficoltà nel controllare la dimensione e la forma degli aggregati cellulari. Questi fattori possono influenzare la riproducibilità e l’affidabilità degli esperimenti condotti su sferoidi cellulari.
Organoidi: organi in miniatura
Come possiamo andare ad una mostra Lego che riproduce in miniatura delle città, allo stesso modo noi scienziati possiamo ottenere una riproduzione in miniatura di organi.
Gli organoidi possono essere formati da cellule staminali pluripotenti (iPSC), cellule staminali embrionali (ESC), cellule staminali adulte (ASC) e cellule tumorali di donatori o pazienti sani. Possono essere coltivati in vitro per lunghi periodi di tempo e sono in grado di replicare molte delle funzioni biologiche degli organi dai quali derivano. Se nei cataloghi della Lego si trova la riproduzione del castello di Howgarts, un modello di organoidi rappresentativo è dato dagli organoidi intestinali, che possono essere generati da cellule staminali tissutali e riprodurre la morfologia e le funzioni fisiologiche dell’intestino. Questi organoidi hanno trovato ampio impiego nella ricerca sulle malattie intestinali, come la malattia di Crohn e il cancro al colon (CRC), consentendo agli scienziati di studiare i meccanismi patogenetici e testare nuovi trattamenti in condizioni controllate.
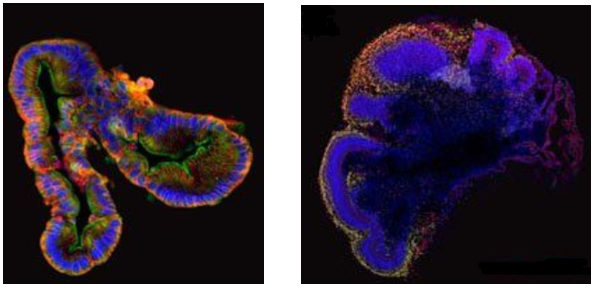
DX: Organoide celebrale umano (STEMCELL Technologies)
Contemporaneamente, anche gli organoidi cerebrali, generati da cellule staminali neurali, stanno rivoluzionando la ricerca sullo sviluppo cerebrale e le malattie neurodegenerative come il Parkinson. Questi modelli possono essere utilizzati per studiare l’effetto di mutazioni genetiche, lesioni cerebrali e agenti patogeni sullo sviluppo e sulla funzione cerebrale, aprendo nuove prospettive per la ricerca sulle malattie neurodegenerative e lo sviluppo di terapie innovative.
Blastoidi: Una rappresentazione dei Primi Stadi dello Sviluppo Umano
In questo caso, non si sta parlando di Pokemon, anche se il nome lo rimanda…
I blastoidi rappresentano una nuova frontiera nella ricerca sulla riproduzione in vitro focalizzandosi sullo studio dei primi stadi dello sviluppo. Si è dimostrato che le cellule staminali del topo si auto-organizzano in strutture simili a blastocisti che vengono chiamate blastoidi. Poiché i blastoidi possono essere generati in grandi numeri, possono essere manipolati con precisione e impiantati in utero.
L’utilizzo di blastoidi offre agli scienziati un’opportunità senza precedenti per studiare i principi dello sviluppo pre e post impianto. Inoltre, i blastoidi possono essere utilizzati per testare l’efficacia e la sicurezza di terapie innovative, come la terapia genica, prima di essere applicate clinicamente.
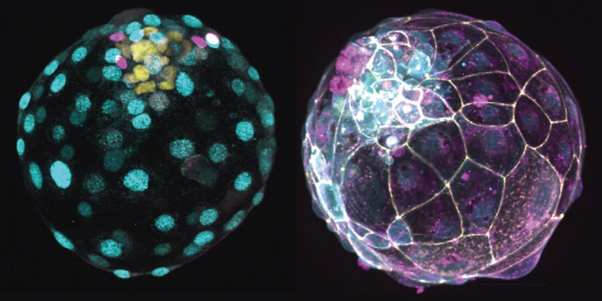
(Rivron lab/Nature/IMBA)
Tuttavia, l’uso di blastoidi solleva anche questioni etiche e sociali, in quanto potrebbe sollevare preoccupazioni riguardo ad approcci non etici alla riproduzione umana. Al momento si è riusciti a concentrarsi sulle opportunità di ricercare in laboratorio i principi fondamentali dello sviluppo o i piccoli difetti che possono impedire l’impianto del concepito o possono contribuire a gravidanze non ottimali, come può essere uno sviluppo non ottimale della placenta.
Gastruloidi: Un Viaggio nel Cuore dello Sviluppo
Sebbene il nome possa incutere timore, i gastruloidi rappresentano uno delle più importanti innovazioni nel campo dei modelli 3D cellulari. Questi modelli, generati da cellule staminali embrionali (ESC), sono in grado di mimare la formazione dei tre fogli embrionali: ectoderma, mesoderma ed endoderma durante il processo di differenziamento.
La capacità dei gastruloidi di riprodurre la gastrulazione in vitro offre agli scienziati una occasione per studiare i meccanismi che guidano la formazione dei tessuti durante lo sviluppo embrionale. Inoltre, possono essere utilizzati per analizzare le cause alla base di difetti congeniti e malattie dello sviluppo associati a anomalie nella gastrulazione: difetti cardiaci congeniti, anomalie del tubo neurale e altre malformazioni congenite.
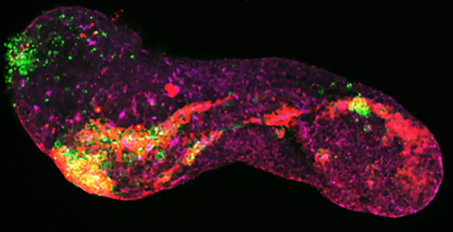
(López-Anguita et al., Development, 2022 / MPIMG)
Tuttavia, l’utilizzo dei gastruloidi solleva anche questioni etiche e sociali, simili a quelle sollevate dai blastoidi. La capacità di generare strutture tridimensionali che imitano gli stadi precoci dello sviluppo embrionale umano potrebbe portare a dibattiti sulla manipolazione degli embrioni e sulla creazione di organismo umano-artificiale. Vi è però da evidenziare che questi modelli consentono il disaccoppiamento di processi che nell’embrione sono strettamente collegati, come la specificazione dell’asse anteroposteriore e lo sviluppo neurale anteriore o la specificazione dell’endoderma e l’allungamento assiale. Ciò potrebbe essere interpretato nel senso che, nel complesso, gli aggregati non riflettono la situazione in vivo.
In conclusione, i modelli 3D della biologia rappresentano un vero approdo per le nuove scoperte e ricerche nella biologia, possono aiutare ad esplorare i segreti più intricati della vita, trasformando le idee in solide realtà.
Fiorenza Sella
Bibliografia:
- Nath S, Devi GR. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacol Ther. 2016 Jul;163:94-108. doi: 10.1016/j.pharmthera.2016.03.013. Epub 2016 Apr 8. PMID: 27063403; PMCID: PMC4961208.
- Decarli MC, Amaral R, Santos DPD, Tofani LB, Katayama E, Rezende RA, Silva JVLD, Swiech K, Suazo CAT, Mota C, Moroni L, Moraes ÂM. Cell spheroids as a versatile research platform: formation mechanisms, high throughput production, characterization and applications. Biofabrication. 2021 Apr 8;13(3). doi: 10.1088/1758-5090/abe6f2. PMID: 33592595.
- Lehmann R, Lee CM, Shugart EC, Benedetti M, Charo RA, Gartner Z, Hogan B, Knoblich J, Nelson CM, Wilson KM. Human organoids: a new dimension in cell biology. Mol Biol Cell. 2019 May 1;30(10):1129-1137. doi: 10.1091/mbc.E19-03-0135. PMID: 31034354; PMCID: PMC6724519.
- Taelman J, Diaz M, Guiu J. Human Intestinal Organoids: Promise and Challenge. Front Cell Dev Biol. 2022 Mar 11;10:854740. doi: 10.3389/fcell.2022.854740. PMID: 35359445; PMCID: PMC8962662.
- An update on human pre- and peri-implantation development: a blueprint for blastoids. David L*, Bruneau A, Fréour T, Rivron N, Van de Velde H. Current Opinion Genetic Development. 2023 Dec;83:102125. doi: 10.1016/j.gde.2023.102125. Epub 2023 Oct 4. PMID: 37801801.
- van den Brink SC, Baillie-Johnson P, Balayo T, Hadjantonakis AK, Nowotschin S, Turner DA, Martinez Arias A. Symmetry breaking, germ layer specification and axial organisation in aggregates of mouse embryonic stem cells. Development. 2014 Nov;141(22):4231-42. doi: 10.1242/dev.113001. PMID: 25371360; PMCID: PMC4302915.
